- Autore Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:42.
- Ultima modifica 2025-06-01 07:37.
La differenza fondamentale tra le reazioni del primo e del secondo ordine è che la velocità delle reazioni del primo ordine dipende dalla prima potenza della concentrazione del reagente nell'equazione della velocità mentre la velocità delle reazioni del secondo ordine dipende dalla seconda potenza della concentrazione termine nell'equazione del tasso.
L'ordine di una reazione è la somma delle potenze a cui vengono elevate le concentrazioni dei reagenti nell'equazione della legge di velocità. Esistono diverse forme di reazione secondo questa definizione; reazioni di ordine zero (queste reazioni non dipendono dalla concentrazione dei reagenti), reazioni del primo ordine e reazioni del secondo ordine.
Quali sono le reazioni del primo ordine?
Le reazioni del primo ordine sono reazioni chimiche la cui velocità di reazione dipende dalla concentrazione molare di uno dei reagenti coinvolti nella reazione. Pertanto, secondo la definizione di cui sopra per l'ordine di reazione, la somma delle potenze a cui le concentrazioni dei reagenti vengono elevate nell'equazione della legge di velocità sarà sempre 1. Può esserci un singolo reagente che prende parte a queste reazioni. Quindi la concentrazione di quel reagente determina la velocità della reazione. Ma a volte, ci sono più reagenti che prendono parte a queste reazioni, quindi uno di questi reagenti determinerà la velocità della reazione.
Consideriamo un esempio per comprendere questo concetto. Nella reazione di scomposizione di N2O5, forma NO2 e O 2 gas come prodotti. Poiché ha un solo reagente, possiamo scrivere la reazione e l'equazione della velocità come segue.
2N2O5(g) → 4NO2(g) + O 2(g)
Tasso=k[N2O5(g)]m
Qui k è la costante di velocità per questa reazione e m è l'ordine della reazione. Pertanto, da determinazioni sperimentali, il valore di m è 1. Quindi, questa è una reazione del primo ordine.
Cosa sono le reazioni del secondo ordine?
Le reazioni di secondo ordine sono reazioni chimiche la cui velocità di reazione dipende dalla concentrazione molare di due dei reagenti o dalla seconda potenza di un reagente coinvolta nella reazione. Pertanto, secondo la definizione di cui sopra per l'ordine di reazione, la somma delle potenze a cui vengono elevate le concentrazioni dei reagenti nell'equazione della legge di velocità sarà sempre 2. Se ci sono due reagenti, la velocità di reazione dipenderà dalla prima potenza della concentrazione di ciascun reagente.
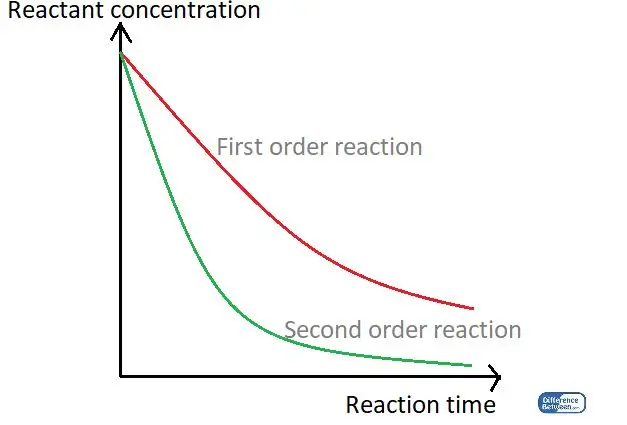
Figura 01: un grafico che confronta i due tipi di ordine di reazione utilizzando il loro tempo di reazione e la concentrazione del reagente.
Se aumentiamo la concentrazione di un reagente di 2 volte (se ci sono due reagenti nell'equazione della velocità), la velocità di reazione aumenta di 4 volte. Ad esempio, consideriamo la seguente reazione.
2LA → P
Qui A è un reagente e P è il prodotto. Quindi, se questa è una reazione del secondo ordine, l'equazione della velocità per questa reazione è la seguente.
Tasso=k[LA]2
Ma per una reazione con due diversi reagenti come segue;
LA + SI → RE
Tasso=k[LA]1[B]1
Qual è la differenza tra le reazioni del primo e del secondo ordine?
Le reazioni del primo ordine sono reazioni chimiche la cui velocità di reazione dipende dalla concentrazione molare di uno dei reagenti coinvolti nella reazione. Pertanto, se aumentiamo la concentrazione del reagente di 2 volte, la velocità di reazione aumenta di 2 volte. Le reazioni del secondo ordine sono reazioni chimiche la cui velocità di reazione dipende dalla concentrazione molare di due dei reagenti o dalla seconda potenza di un reagente coinvolta nella reazione. Quindi, se aumentiamo la concentrazione del reagente di 2 volte, la velocità di reazione aumenta di 4 volte. L'infografica qui sotto presenta la differenza tra le reazioni del primo e del secondo ordine in forma tabellare.

Riepilogo - Reazioni del primo e del secondo ordine
Ci sono tre tipi principali di reazioni in base all'ordine della reazione; reazioni di ordine zero, primo e secondo ordine. La differenza chiave tra le reazioni del primo e del secondo ordine è quella la velocità di una reazione del primo ordine dipende dalla prima potenza della concentrazione del reagente nell'equazione della velocità mentre la velocità di una reazione del secondo ordine dipende dalla seconda potenza del termine di concentrazione nell'equazione equazione del tasso.






