- Autore Alex Aldridge [email protected].
- Public 2023-12-17 13:42.
- Ultima modifica 2025-06-01 07:37.
Differenza chiave - Metano vs Etano
Metano ed Etano sono i membri più piccoli della famiglia degli alcani. Le formule molecolari di questi due composti organici sono rispettivamente CH4 e C2H6. La differenza chiave tra metano ed etano è la loro struttura chimica; una molecola di etano può essere considerata come due gruppi metilici uniti come un dimero di gruppi metilici. Le altre differenze chimiche e fisiche sorgono principalmente a causa di questa differenza strutturale.
Cos'è il metano?
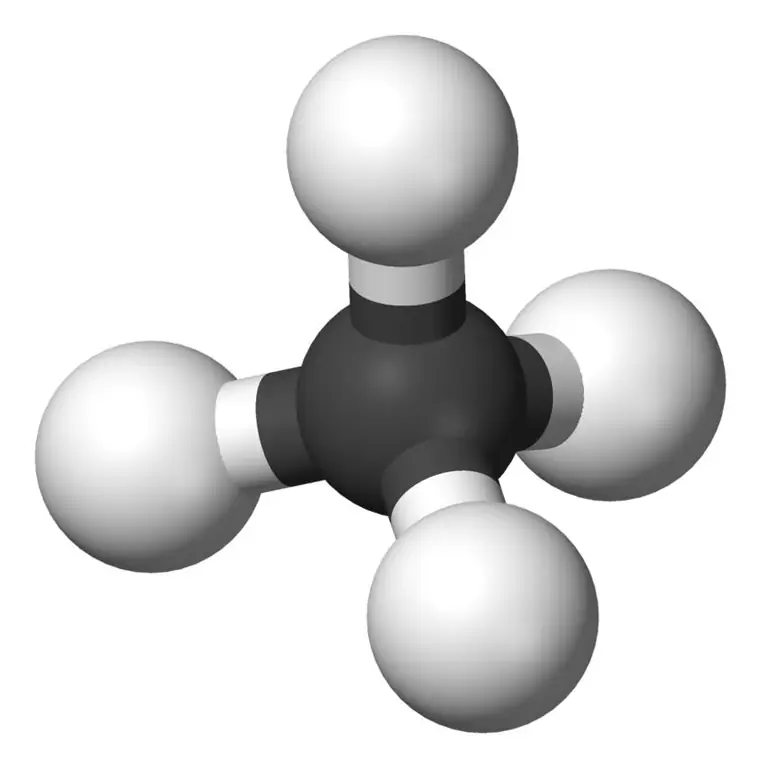
Il metano è il membro più piccolo della famiglia degli alcani con la formula chimica CH4(quattro atomi di idrogeno sono legati a un atomo di carbonio). È considerato il principale componente del gas naturale. Il metano è un gas incolore, inodore e insapore; noto anche come carbane, gas di palude, gas naturale, tetraidruro di carbonio e carburo di idrogeno. Si accende facilmente e il suo vapore è più leggero dell'aria.
Il metano si trova naturalmente sotto terra e sotto il fondale marino. Il metano atmosferico è considerato un gas serra. Il metano si scompone in CH3- con l'acqua nell'atmosfera.
Cos'è l'etano?
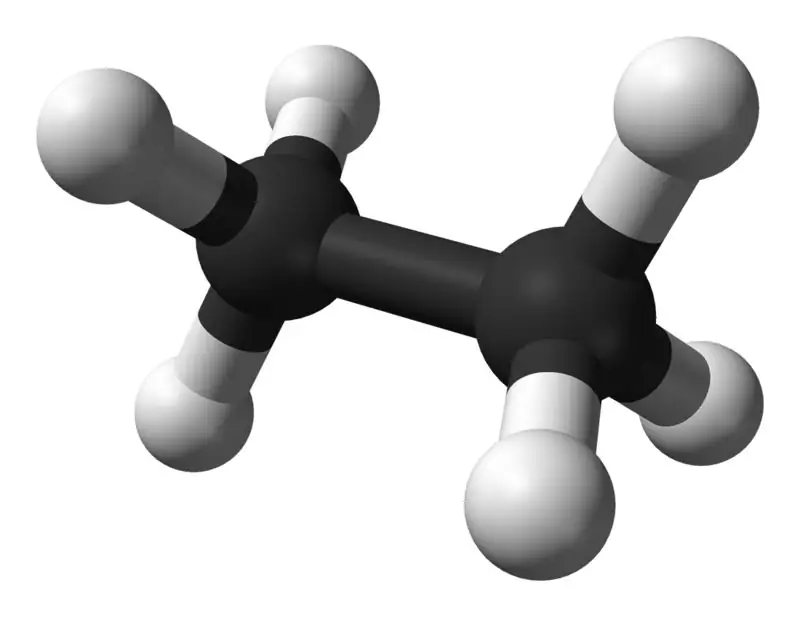
L'etano è un composto gassoso incolore e inodore a temperatura e pressione standard. La sua formula molecolare e il suo peso molecolare sono rispettivamente C2H6 e 30,07 g·mol−1. È isolato dal gas naturale, come sottoprodotto del processo di raffinazione del petrolio. L'etano è molto importante nella produzione di etilene.
Qual è la differenza tra metano ed etano?
Caratteristiche di metano ed etano
Struttura:
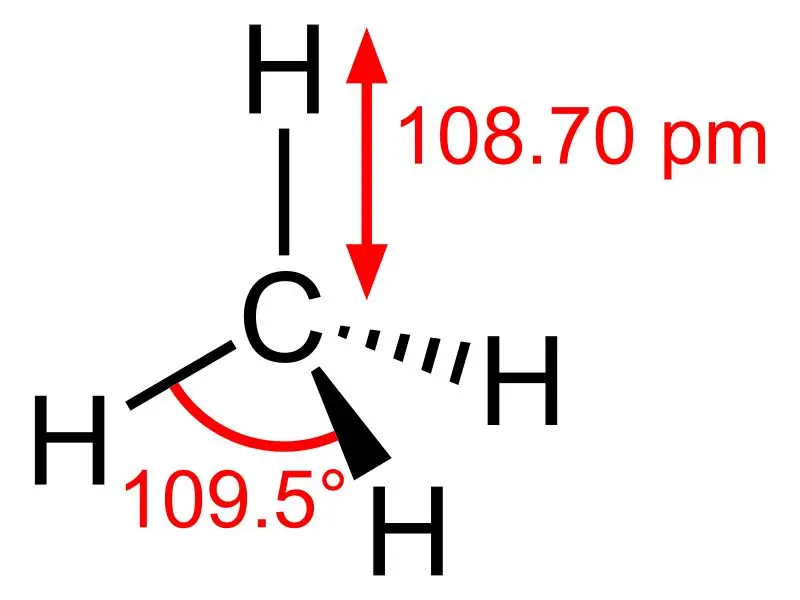
Metano: la formula molecolare del metano è CH4, ed è un esempio di molecola tetraedrica con quattro legami C-H equivalenti (legami sigma). L'angolo di legame tra gli atomi H-C-H è 109,50 e tutti i legami C-H sono equivalenti ed è pari a 108,70 pm.
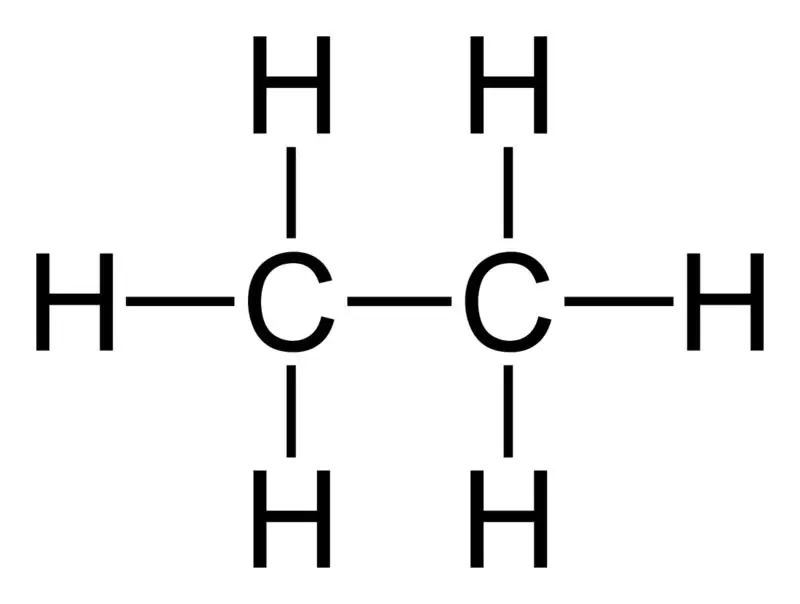
Etano: La formula molecolare dell'etano è C2H6,ed è un idrocarburo saturo poiché non contiene legami multipli.
Proprietà chimiche:
Metano:
Stabilità: il metano è una molecola chimicamente molto stabile che non reagisce con KMnO4, K2Cr 2O7, H2SO4 o HNO 3 in condizioni normali.
Combustione: In presenza di aria o ossigeno in eccesso, il metano brucia con una fiamma azzurra non luminosa che produce anidride carbonica e acqua. È una reazione altamente esotermica; pertanto, viene utilizzato come ottimo combustibile. In presenza di aria o ossigeno insufficienti, brucia parzialmente trasformandosi in monossido di carbonio (CO).
Reazioni di sostituzione: il metano mostra reazioni di sostituzione con alogeni. In queste reazioni uno o più atomi di idrogeno vengono sostituiti da un numero uguale di atomi di alogeno e si parla di “alogenazione.” Reagisce con cloro (Cl) e bromo (Br) in presenza di luce solare.
Reazione con il vapore: quando una miscela di metano e vapore viene fatta passare attraverso un nichel riscaldato (1000 K) supportato su una superficie di allumina, può produrre idrogeno.
Pirolisi: quando il metano viene riscaldato a circa 1300 K, si decompone in nerofumo e idrogeno.
Etano:
Reazioni: Il gas etano (CH3CH3) reagisce con i vapori di bromo in presenza di luce per formare bromoetano, (CH 3CH2Br) e acido bromidrico (HBr). È una reazione di sostituzione; un atomo di idrogeno in etano è sostituito da un atomo di bromo.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Combustione: la combustione completa dell'etano produce 1559,7 kJ/mol (51,9 kJ/g) di calore, anidride carbonica e acqua.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Può verificarsi anche senza un eccesso di ossigeno, producendo una miscela di carbonio amorfo e monossido di carbonio.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energia
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energia
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energia ecc.
Definizioni:
Reazioni di sostituzione: la reazione di sostituzione è una reazione chimica che comporta lo spostamento di un gruppo funzionale in un composto chimico e la sua sostituzione con un altro gruppo funzionale.
Usi:
Metano: il metano viene utilizzato in molti processi chimici industriali (come combustibile, gas naturale, gas naturale liquefatto) e viene trasportato come fluido refrigerato.
Etano: l'etano viene utilizzato come combustibile per i motori e come refrigerante per un sistema a temperatura estremamente bassa. Viene spedito in bombole di acciaio come gas liquefatto alla propria pressione di vapore.






